《(廣東專版)2022高考化學(xué)二輪復(fù)習(xí) 第二部分 非選擇題專項(xiàng)練(三)》由會員分享�����,可在線閱讀,更多相關(guān)《(廣東專版)2022高考化學(xué)二輪復(fù)習(xí) 第二部分 非選擇題專項(xiàng)練(三)(6頁珍藏版)》請?jiān)谘b配圖網(wǎng)上搜索���。
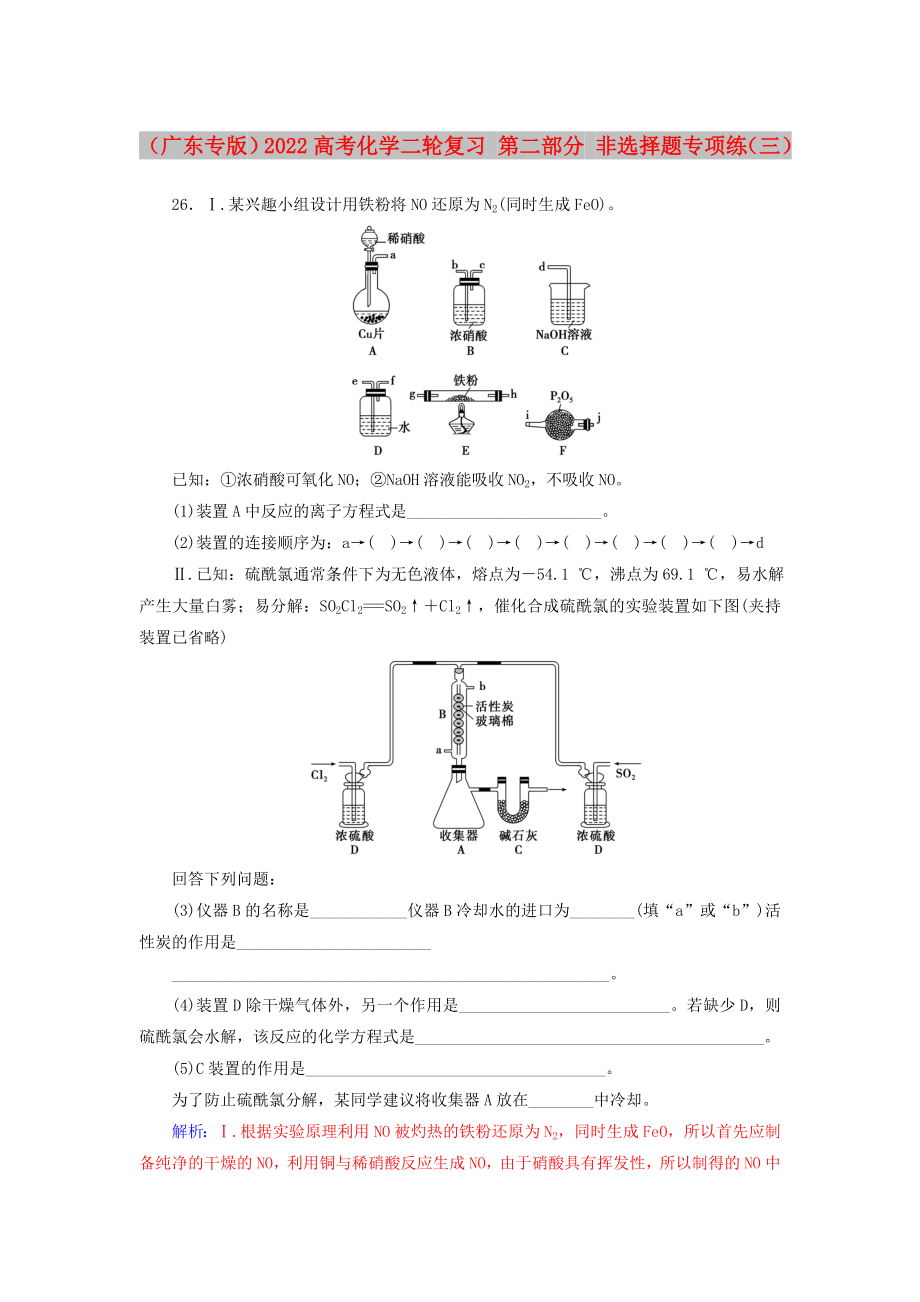
1�����、(廣東專版)2022高考化學(xué)二輪復(fù)習(xí) 第二部分 非選擇題專項(xiàng)練(三)26.某興趣小組設(shè)計(jì)用鐵粉將NO還原為N2(同時生成FeO)����。已知:濃硝酸可氧化NO��;NaOH溶液能吸收NO2����,不吸收NO。(1)裝置A中反應(yīng)的離子方程式是_��。(2)裝置的連接順序?yàn)椋篴()()()()()()()()d.已知:硫酰氯通常條件下為無色液體���,熔點(diǎn)為54.1 ��,沸點(diǎn)為69.1 �����,易水解產(chǎn)生大量白霧����;易分解:SO2Cl2=SO2Cl2,催化合成硫酰氯的實(shí)驗(yàn)裝置如下圖(夾持裝置已省略)回答下列問題:(3)儀器B的名稱是_儀器B冷卻水的進(jìn)口為_(填“a”或“b”)活性炭的作用是_����。(4)裝置D除干燥氣體外,另一個作用是_
2��、����。若缺少D,則硫酰氯會水解��,該反應(yīng)的化學(xué)方程式是_���。(5)C裝置的作用是_。為了防止硫酰氯分解�,某同學(xué)建議將收集器A放在_中冷卻。解析:.根據(jù)實(shí)驗(yàn)原理利用NO被灼熱的鐵粉還原為N2�����,同時生成FeO,所以首先應(yīng)制備純凈的干燥的NO�,利用銅與稀硝酸反應(yīng)生成NO,由于硝酸具有揮發(fā)性�����,所以制得的NO中會混有硝酸和水蒸氣氣體����,則先通過裝置D除去揮發(fā)出的HNO3等酸性氣體,然后再通過F干燥���,得到純凈的干燥的NO進(jìn)入E中與鐵粉反應(yīng)��,最后處理多余的NO�,又因?yàn)镹aOH溶液不與NO反應(yīng)����,而濃硝酸可氧化NO生成NO2,所以最終先通過B氧化NO���,后再通過C吸收����。(1)裝置A中銅與稀硝酸反應(yīng)的離子方程式為3Cu8H2
3、NO=3Cu22NO4H2O��。(2)根據(jù)以上分析���,先制備NO除硝酸氣體除水蒸氣氧化鐵粉氧化多余的NONaOH溶液吸收�����,所以上述裝置接口的連接順序?yàn)閍fejihg(或gh)bcd���。.(3)根據(jù)裝置圖,儀器B為球型冷凝管����,根據(jù)采用逆流的冷凝效果好,所以冷凝管中的冷卻水進(jìn)口為a�����,活性炭作催化劑���。(4)D裝置的濃硫酸用來干燥氣體���,防止硫酰氯水解,同時還可以通過觀察氣泡控制氣體流速��;若無D���,硫酰氯水解為硫酸和鹽酸����?;瘜W(xué)方程式為:SO2Cl22H2O=H2SO42HCl。(5)SO2Cl2易分解放出SO2和Cl2�,C裝置中的堿石灰可以吸收SO2和Cl2,防止空氣污染���;為了防止硫酰氯分解�,可將收集器A放在冰
4����、水中冷卻。答案:(1)3Cu8H2NO=3Cu22NO4H2O(2)fejihg(或gh)bc(3)球形冷凝管a催化劑(4)通過觀察氣泡控制氣流速度(或比例)SO2Cl22H2O=H2SO42HCl(5)吸收SO2和Cl2���,防止空氣污染冰水浴27CoCl26H2O是一種飼料營養(yǎng)強(qiáng)化劑�。一種利用水鈷礦主要成分為Co2O3、Co(OH)3����,還含少量Fe2O3、Al2O3���、MnO等制取CoCl26H2O的工藝流程如下:已知:浸出液含有的陽離子主要有H�、Co2����、Ca2、Mg2���、Fe2��、Mn2���、Al3等;部分陽離子以氫氧化物形式沉淀時溶液的pH見下表:沉淀物Fe(OH)3Fe(OH)2Co(OH)2Al
5�����、(OH)3Mn(OH)2開始沉淀2.77.67.64.07.7完全沉淀3.79.69.25.29.8CoCl26H2O熔點(diǎn)86 ,易溶于水����、乙醚等�;常溫下穩(wěn)定無毒,加熱至110120 時����,失去結(jié)晶水變成有毒的無水氯化鈷。(1)寫出浸出過程中Co2O3發(fā)生反應(yīng)的離子方式_�����。(2)NaClO3的作用是_寫出該反應(yīng)的離子方程式_�����;若不慎向“浸出液”中加過量NaClO3時����,可能會生成有毒氣體是_(填化學(xué)式)。(3)加Na2CO3調(diào)pH至5.2所得沉淀為_�����。(4)萃取劑對金屬離子的萃取率與pH的關(guān)系如下圖。加萃取劑的目的是_����;其使用的最佳pH范圍是(填字母代號)_。A2.02.5B3.03.5C4.04
6����、.5 D5.05.5(5)操作1包含3個基本實(shí)驗(yàn)操作是蒸發(fā)、結(jié)晶和過濾���,制得的CoCl26H2O需減壓烘干的原因是_�����。解析:水鈷礦中加入鹽酸��、Na2SO3后的浸出液含有的陽離子主要有H���、Co2、Ca2�、Mg2、Fe2����、Mn2���、Al3等,加入NaClO3��,可以將Fe2氧化得到Fe3����,然后加入Na2CO3調(diào)pH至5.2���,可得到Fe(OH)3�、Al(OH)3沉淀�,過濾后所得濾液中加入NaF除去Ca2、Mg2�����,在用萃取劑萃取�����,得到的溶液中主要含有CoCl2�,為得到CoCl26H2O晶體,應(yīng)控制溫度在86 以下�����,加熱時要防止溫度過高而失去結(jié)晶水,可減壓烘干�����。(1)酸性條件下����,Co2O3和SO發(fā)生氧化還原
7、反應(yīng)生成Co2�����、SO��,反應(yīng)離子方程式為:Co2O3SO4H=2Co2SO2H2O���。(2)酸性條件下����,加入NaClO3將Fe2氧化為Fe3���,便于調(diào)節(jié)pH轉(zhuǎn)化成氫氧化鐵沉淀而除去����,反應(yīng)的離子方程式為ClO6Fe26H=Cl6Fe33H2O,若不慎向“浸出液”中加過量NaClO3時���,氯酸鈉能夠氧化氯離子反應(yīng)生成氯氣�����。(3)“加Na2CO3調(diào)pH至5.2”�����,目的是除去鐵離子、鋁離子�,將鐵離子、鋁離子轉(zhuǎn)化為Fe(OH)3���、Al(OH)3沉淀����,過濾除去�。(4)根據(jù)流程圖可知,此時溶液中存在Mn2���、Co2金屬離子�����,由萃取劑對金屬離子的萃取率與pH的關(guān)系可知����,調(diào)節(jié)溶液pH在3.03.5之間,可使Mn2被萃取�����,
8����、并防止Co2被萃取。(5)操作1包含3個基本實(shí)驗(yàn)操作是蒸發(fā)����、結(jié)晶和過濾,制得的CoCl26H2O需減壓烘干��,目的是降低烘干溫度���,防止產(chǎn)品分解�����。答案:(1)Co2O3SO4H=2Co2SO2H2O(2)將Fe2氧化成Fe3ClO6Fe26H=Cl6Fe33H2OCl2(3)Fe(OH)3Al(OH)3(4)除去溶液中的Mn2B(5)降低烘干溫度��,防止產(chǎn)品分解28甲醇是一種可再生能源���,具有廣闊的開發(fā)和應(yīng)用前景���,其合成反應(yīng)為CO(g)2H2(g)CH3OH(g)。(1)下表列出了一些化學(xué)鍵斷裂需要的能量數(shù)據(jù)��,則CO(g)2H2(g)CH3OH(g)H_�。化學(xué)鍵HHCOCOHOCHE/kJmol143
9�����、63431 076465413工業(yè)上用天然氣為原料合成甲醇���,分為兩階段。.制備合成氣:CH4H2O(g)=CO3H2�����。(2)為解決合成氣中H2過量CO不足問題,原料氣中添加CO2��,發(fā)生反應(yīng)CO2H2=COH2O���。為了使合成氣配比最佳����,理論上原料氣中甲烷與二氧化碳體積比為_�。.合成甲醇:實(shí)驗(yàn)室進(jìn)行模擬合成實(shí)驗(yàn)。將1 mol CO和2 mol H2通入密閉容器中��,測得CO在不同溫度下的平衡轉(zhuǎn)化率與壓強(qiáng)的關(guān)系如圖所示:(3)比較T1�、T2、T3的大小���,并說明理由_�����。(4)平衡常數(shù)K(b)_K(d)��、正反應(yīng)速率v(a)_v(b)(均填“大于”“小于”或“等于”)�。(5)c點(diǎn)時反應(yīng)的壓強(qiáng)平衡常數(shù)Kp_(
10、kPa)2(用數(shù)字表達(dá)式表示�����,Kp是用平衡分壓代替平衡濃度計(jì)算�����,分壓總壓物質(zhì)的量分?jǐn)?shù))�����。(6)a點(diǎn)時�����,保持溫度不變��,將密閉容器的容積壓縮到原來的一半�����,對平衡體系產(chǎn)生的影響是_(填序號)��。Ac(H2)減少B正反應(yīng)速率加快��,逆反應(yīng)速率減慢CCH3OH的物質(zhì)的量增加D重新平衡時減小ECH3OH的體積分?jǐn)?shù)增加解析:(1)根據(jù)H反應(yīng)物斷鍵吸收的總能量生成物成鍵放出的總能量1 0762436(3413343465)99 kJmol1�����。.(2)由CO(g)2H2(g)CH3OH(g)可以知道�,理論上一氧化碳與氫氣按n(CO)n(H2)12進(jìn)行反應(yīng),由反應(yīng)CH4(g)H2O(g)CO(g)3H2(g)可以知道
11���、1 mol甲烷生成1 mol CO與3 mol H2�,H2過量1 mol�����,過量的氫氣與二氧化碳反應(yīng)��,根據(jù)反應(yīng)CO2(g)3H2(g)CH3OH(g)H2O(g)可以知道1 mol H2需二氧化碳 mol���,所以理論上原料氣中甲烷與二氧化碳體積比為1 mol mol31��。(3)該反應(yīng)正反應(yīng)為放熱反應(yīng)����,溫度升高平衡逆向移動���,CO的平衡轉(zhuǎn)化率減小����,所以溫度由小到大的順序?yàn)門1T2T3。(4)由于平衡常數(shù)為溫度的函數(shù)�����,溫度不變��,平衡常數(shù)不變��,所以平衡常數(shù)K(b)K(d)���;溫度高反應(yīng)速率快�,因?yàn)門1T2��,所以正反應(yīng)速率v(a)v(b)��。(5)已知將1 mol CO和2 mol H2通入密閉容器中���,一氧化碳
12���、的平衡轉(zhuǎn)化率為35%;計(jì)算如下:CO(g) 2H2(g)CH3OH(g)起始量 1 2 0變化量 0.35 0.7 0.35平衡量 0.65 1.3 0.35平衡分壓 c點(diǎn)時反應(yīng)的壓強(qiáng)平衡常數(shù)Kp2����。(6)針對反應(yīng)CO(g)2H2(g)CH3OH(g),保持溫度不變�����,將密閉容器的容積壓縮到原來的一半����,相當(dāng)于加壓過程,平衡右移��,氫氣的物質(zhì)的量減少�����,但濃度增大����,所以c(H2)增大,A錯誤��;體積變小�����,各物質(zhì)濃度增大,正反應(yīng)速率加快���,逆反應(yīng)速率也加快���,B錯誤;體積縮小��,壓強(qiáng)增大��,平衡右移��,CH3OH的物質(zhì)的量增加�,C正確;將容器的容積壓縮到原來的��,壓強(qiáng)增大��,正�、逆反應(yīng)速率都增大,平衡向正反應(yīng)方向移動�����,CH3OH的物質(zhì)的量增加,濃度增大�����,氫氣的物質(zhì)的量減少�����,但濃度增大���;故有減小,D正確����;平衡右移CH3OH的物質(zhì)的量增加,CH3OH的體積分?jǐn)?shù)積分?jǐn)?shù)增加���,E正確��;正確答案:CDE�����。答案:(1)99 kJmol1(2)31(3)T1T2T3為該反應(yīng)的正反應(yīng)為放熱反應(yīng)�,溫度升高平衡逆向移動,CO的平衡轉(zhuǎn)化率減小(4)等于小于(5)(6)CDE
 (廣東專版)2022高考化學(xué)二輪復(fù)習(xí) 第二部分 非選擇題專項(xiàng)練(三)
(廣東專版)2022高考化學(xué)二輪復(fù)習(xí) 第二部分 非選擇題專項(xiàng)練(三)