《1.2 化學(xué)計(jì)量在實(shí)驗(yàn)中的應(yīng)用(第二課時(shí))》由會(huì)員分享��,可在線閱讀�����,更多相關(guān)《1.2 化學(xué)計(jì)量在實(shí)驗(yàn)中的應(yīng)用(第二課時(shí))(4頁(yè)珍藏版)》請(qǐng)?jiān)谘b配圖網(wǎng)上搜索。
1�����、1.2 化學(xué)計(jì)量在實(shí)驗(yàn)中的應(yīng)用(第二學(xué)時(shí))
【大成目的】(課堂2分鐘解讀目的)
1��、通過(guò)對(duì)1 mol物質(zhì)體積的討論�����,理解氣體摩爾體積的概念��;(重點(diǎn))
2����、通過(guò)對(duì)氣體摩爾體積概念的理解,讓學(xué)生理解物質(zhì)的量��、氣體摩爾體積和氣體的體積之間的關(guān)系����;(難點(diǎn))
3、初步學(xué)會(huì)分析解決數(shù)據(jù)���、推理演繹��、歸納總結(jié)的科學(xué)學(xué)習(xí)措施
【使用闡明】
1�����、 通過(guò)學(xué)生計(jì)算�����,體驗(yàn)氣體摩爾體積和氣體的體積之間的關(guān)系�����,從而突破難點(diǎn)���;通過(guò)升華案來(lái)強(qiáng)化重難點(diǎn);
2�、 建議學(xué)時(shí):1學(xué)時(shí)。
基本案(8分鐘)
課前預(yù)習(xí)20分鐘并完畢���,課堂8分鐘展示
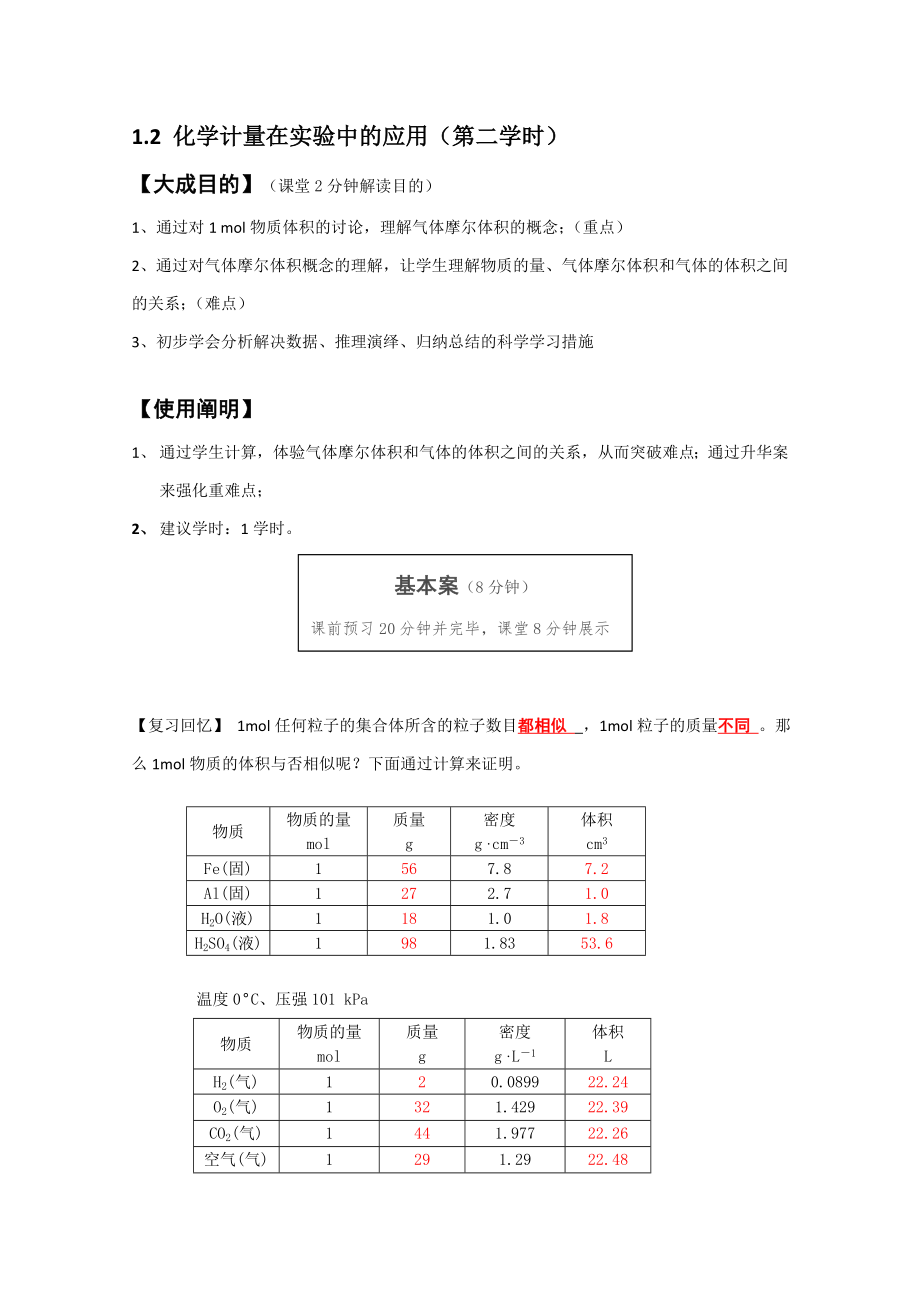
【復(fù)習(xí)回憶】 1mol任何粒子的集合體所含
2�、的粒子數(shù)目都相似 ��,1mol粒子的質(zhì)量不同 。那么1mol物質(zhì)的體積與否相似呢�����?下面通過(guò)計(jì)算來(lái)證明����。
物質(zhì)
物質(zhì)的量
mol
質(zhì)量
g
密度
g·cm-3
體積
cm3
Fe(固)
1
56
7.8
7.2
Al(固)
1
27
2.7
1.0
H2O(液)
1
18
1.0
1.8
H2SO4(液)
1
98
1.83
53.6
溫度0°C、壓強(qiáng)101 kPa
物質(zhì)
物質(zhì)的量
mol
質(zhì)量
g
密度
g·L-1
體積
L
H2(氣)
1
2
0.0899
22.24
O2(氣)
1
32
3����、
1.429
22.39
CO2(氣)
1
44
1.977
22.26
空氣(氣)
1
29
1.29
22.48
升華案(20分鐘)
小組討論學(xué)習(xí),教師隨時(shí)點(diǎn)撥
【小組討論分享】
在溫度和壓強(qiáng)一定期���,物質(zhì)的體積重要由物質(zhì)所含①物質(zhì)所含粒子的數(shù)目�����、②粒子的大小�、③粒子之間的距離 決定���。當(dāng)粒子數(shù)相似�����,粒子間距離很小時(shí)��,決定物質(zhì)體積大小的重要因素是構(gòu)成物質(zhì)的粒子大?���?��;粒子間距離很大時(shí)�,決定物質(zhì)體積大小的重要因素是粒子之間的距離���。
【總結(jié)歸納】
1��、物質(zhì)在固態(tài)或液態(tài)時(shí)�����,粒子間的平均距離比氣態(tài)小得多�,決定固體���、液體的體積的重要因素是粒子的大小����,由于
4、粒子的大小是不同的��,因此����,1mol不同的固態(tài)或液態(tài)物質(zhì)的體積是不相似的。而氣體物質(zhì)分子之間的距離很大�����,故氣體物質(zhì)的體積重要決定于粒子間的距離���。
小竅門(mén):三同推一同
2�����、決定粒子間距離的重要因素是溫度和壓強(qiáng)��,不同氣體在相似的溫度和壓強(qiáng)下�,分子之間的距離可以看作是相似的���,因此�,粒子數(shù)相似的氣體在相似條件下有著近似相似的體積。在相似溫度和壓強(qiáng)下���,相似體積的任何氣體應(yīng)具有相似數(shù)目的粒子�,
這就是出名的阿伏加德羅定律�����。
學(xué)法指引:氣體的體積受溫度����、壓強(qiáng)的影響很大���,因此�,說(shuō)到氣體的體積時(shí)�,必須指明外界條件,否則就沒(méi)故意義��。
3��、單位物質(zhì)的量的氣體所占的體積稱為氣體摩爾體積���,用Vm (符號(hào)
5�、)表達(dá),單位為 L/mol��,那么在一定溫度和壓強(qiáng)下����,Vm是個(gè)常數(shù),如果條件變化了����,則Vm亦隨之變化。如在0℃�、101 kPa時(shí),Vm=22.4 L/mol�����;在25℃����、101 kPa時(shí),Vm= 24.8 L/mol��。
【歸納總結(jié)】
得出公式:氣體體積V= n?Vm
2. 阿伏加德羅定律推論:同溫同壓下�����,任何氣體的體積之比=物質(zhì)的量 之比=粒子個(gè)數(shù) 之比。
用符號(hào)表達(dá)為:相似T���、P: V1/V2=n1/n2
【構(gòu)建知識(shí)網(wǎng)絡(luò)】小結(jié)物質(zhì)的量�����、質(zhì)量����、粒子數(shù)����、氣體體積之間的互相關(guān)系
鞏固案(8分鐘)
小組獨(dú)立完畢��,分層輔
6���、導(dǎo)達(dá)標(biāo)
A級(jí)
1�����、原則狀況下�����,2.2 g CO2的體積是多少?(0.05×22.4升)
2��、原則狀況下10g氫氣的體積是多少升�����?6.72L二氧化碳?xì)怏w的質(zhì)量為多少克�?
氫氣的體積5×22.4升 二氧化碳?xì)怏w的質(zhì)量為0.3×44g
命題意圖:考察摩爾質(zhì)量、物質(zhì)的量����、微粒數(shù)、氣體摩爾體積之間的關(guān)系�,突出教學(xué)重難點(diǎn)。
3�、既有3.4 g H2S和0.1 mol HBr氣體。
(1)不同條件下����,哪個(gè)分子數(shù)較多? 相似
(2)相似條件下,哪個(gè)該用較大的容器裝? 相似
(3)不同條件下���,哪個(gè)質(zhì)量大?大多少? (HBr大 8.1—3.4=4.7)
(4)哪個(gè)所含H原子的物質(zhì)的量多
7�、?多多少?( H2S多 多6.8-0����。1=6.7)
(5)其中含S和Br各多少克? S的質(zhì)量為:(3.2克Br的質(zhì)量為:8克)
B級(jí)
4����、原則狀況下有(1)6.72LCH4 (2) 3.01×1023個(gè)HCl分子 (3)13.6gH2S����,下列對(duì)這三種氣體的關(guān)系從小到大的排列順序是:
A、物質(zhì)的量_ CH4__HCl____H2S_______ B���、體積__ CH4__HCl____H2S____
C�����、質(zhì)量__HCl__H2S___ CH4______ D����、氫原子數(shù)_ CH4 ___H2S____HC_
C級(jí)
解題措施:先推出物質(zhì)的量之比���,即可求出其她。
N2�、CO2、SO2三種氣體的質(zhì)量比為7:11:16時(shí)����,
它們的分子個(gè)數(shù)比為_(kāi)1:1:1____���;
物質(zhì)的量之比為_(kāi)1:1:1___;
同溫同壓下體積比為_(kāi)_1:1:1___
目的反饋(2分鐘)
1��、 此節(jié)課目的的達(dá)到狀況
2���、 此節(jié)課應(yīng)注意的問(wèn)題
3���、此節(jié)課的收獲
 1.2 化學(xué)計(jì)量在實(shí)驗(yàn)中的應(yīng)用(第二課時(shí))
1.2 化學(xué)計(jì)量在實(shí)驗(yàn)中的應(yīng)用(第二課時(shí))