《湖南省望城縣金海雙語實驗學校九年級化學下冊 8.3 金屬資源的利用(第二課時)導學案(無答案) (新版)新人教版(通用)》由會員分享,可在線閱讀��,更多相關《湖南省望城縣金海雙語實驗學校九年級化學下冊 8.3 金屬資源的利用(第二課時)導學案(無答案) (新版)新人教版(通用)(2頁珍藏版)》請在裝配圖網(wǎng)上搜索�。
1、8.3 金屬資源的利用
課型:
新授課
設計:
審核:
審批:
班級:
小組:
姓名:
使用時間: 月 日 星期
課題:
第 課時
累計 課時
學習過程(定向?qū)W:教材14頁至17頁)
流程及學習內(nèi)容
學習要求和方法
一�����、目標解讀(2分鐘)
1.知道一些常見金屬如鐵�、鋁、銅等的礦物���,了解從鐵礦石中將鐵還原出來的原理及方法��。
2.會根據(jù)化學方程式對含有某些雜質(zhì)的反應物或生成物進行有關計算�����。
學習重點:鐵礦石中將鐵還原出來的原理及方法�����。
學習難點:含雜質(zhì)的計算問題
二�����、夯實基礎(10分鐘)
1�、地球上的
2�、金屬資源的存在形式:少數(shù)金屬以 形式存在,大多數(shù)的金屬以 的形式存在��。
2����、地殼中含量最多的金屬元素是 ,其次是 ����。
3、常見的鐵礦石有 ��。
4、早在 ���,我國就開始生產(chǎn)和使用鐵器����,從1世紀起��, 便成了一種最主要的金屬材料��。
5��、鐵的冶煉
原理: ����;
原料: ;
設備: ����;
產(chǎn)品:
3、 ��。
三����、能力提升(20分鐘)
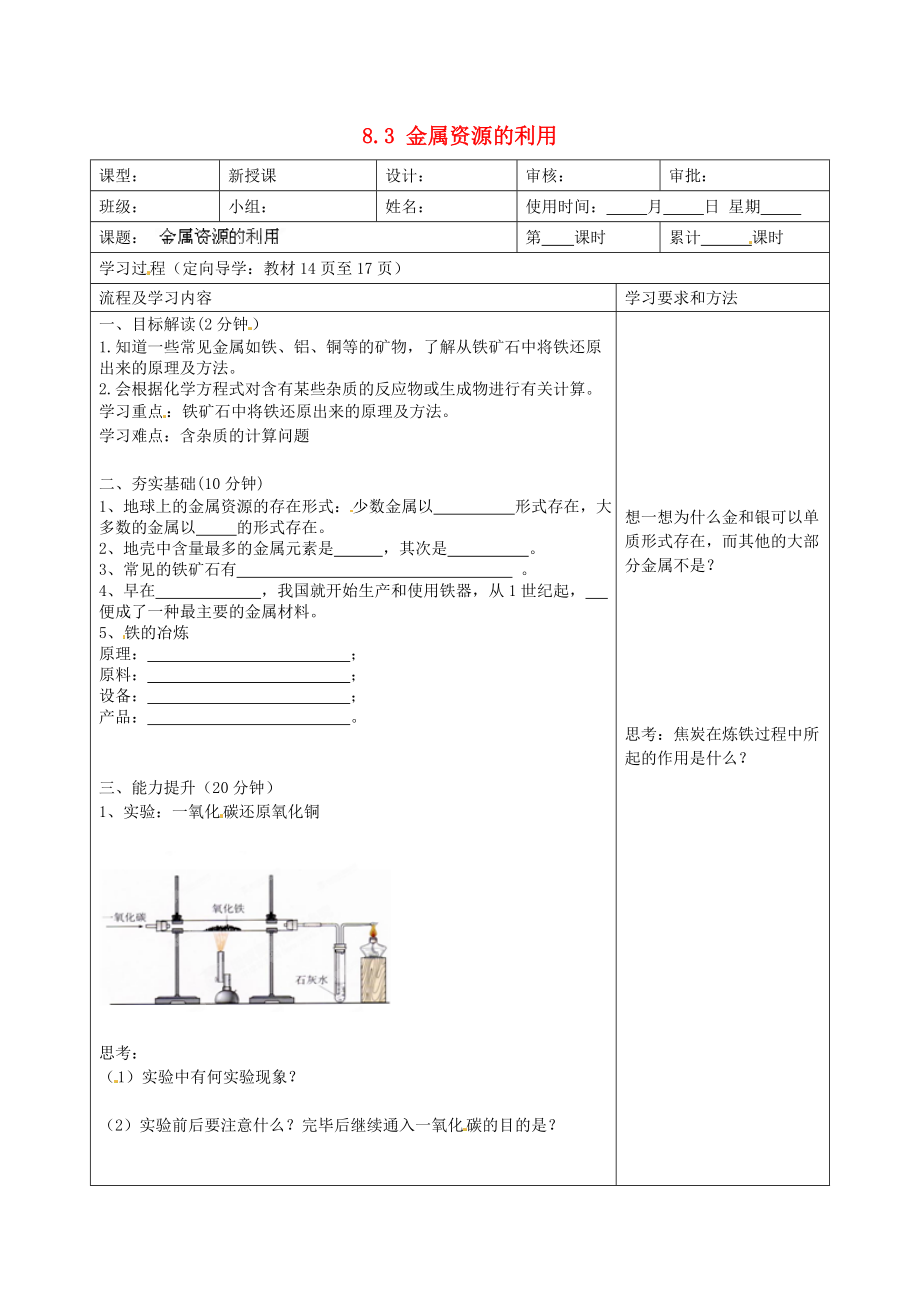
1���、實驗:一氧化碳還原氧化銅
思考:
(1)實驗中有何實驗現(xiàn)象?
(2)實驗前后要注意什么�?完畢后繼續(xù)通入一氧化碳的目的是?
2�����、用1000噸含氧化鐵80%的赤鐵礦石��,理論上可以煉制含鐵96%的生鐵的質(zhì)量是多少�����?
(分析:1000噸 氧化鐵80%的赤鐵礦石中純氧化鐵的質(zhì)量為
質(zhì)量為M的96%生鐵里面含純鐵的質(zhì)量可以表示為 )
解:設
四
4����、����、總結梳理(3分鐘)
煉鐵的原理:
含雜質(zhì)的計算要注意什么?
五����、過關檢測(10分鐘)
1��、有關下列說法正確的是( )
A.煉鐵的原理:2Fe2O3+3C == 4Fe+3CO2↑
B����、赤鐵礦的主要成分(Fe2O3)是金屬材料
C�����、高爐煉鐵的產(chǎn)品是鋼��,廢氣不可以直接排到空氣中
D�、鐵的冶煉利用了CO的還原性
2、下列各項比較中��,正確的是( )
A.含碳量:生鐵>鋼 B.含鐵量:Fe2O3>FeO
C.地殼中元素含量:Fe>Al D.韌性:生鐵>鋼
3�、將燃著的鎂伸入盛有二氧化碳的集氣瓶中,鎂帶劇烈燃燒��,
5��、發(fā)生的反應方程式為2Mg+CO2= 2MgO+C�����,下列敘述錯誤的是( )
A����、該反應中鎂發(fā)生了氧化反應
B��、該反應中二氧化碳是還原劑
C���、該反應屬于置換反應
D、鎂著火時不能用二氧化碳滅火劑撲滅
4��、某工廠要煉出含鐵96%的生鐵800噸�����,理論上需要含氧化鐵80%的赤鐵礦多少噸���?
想一想為什么金和銀可以單質(zhì)形式存在��,而其他的大部分金屬不是�����?
思考:焦炭在煉鐵過程中所起的作用是什么?
生鐵是含有C元素的鐵合金
有關化學式的計算必須是:
純物質(zhì)的計算
 湖南省望城縣金海雙語實驗學校九年級化學下冊 8.3 金屬資源的利用(第二課時)導學案(無答案) (新版)新人教版(通用)
湖南省望城縣金海雙語實驗學校九年級化學下冊 8.3 金屬資源的利用(第二課時)導學案(無答案) (新版)新人教版(通用)