《2022屆高考化學(xué)三輪沖刺 元素周期表的結(jié)構(gòu)導(dǎo)學(xué)案》由會員分享��,可在線閱讀�,更多相關(guān)《2022屆高考化學(xué)三輪沖刺 元素周期表的結(jié)構(gòu)導(dǎo)學(xué)案(6頁珍藏版)》請在裝配圖網(wǎng)上搜索。
1����、2022屆高考化學(xué)三輪沖刺 元素周期表的結(jié)構(gòu)導(dǎo)學(xué)案
考點剖析
一���、元素周期表
1.編排原則
(1)周期:把電子層數(shù)相同的元素按原子序數(shù)遞增順序從左到右排列成一橫行。
(2)族:把不同橫行中最外層電子數(shù)相同的元素�,按電子層數(shù)遞增的順序從上到下排成一縱行。
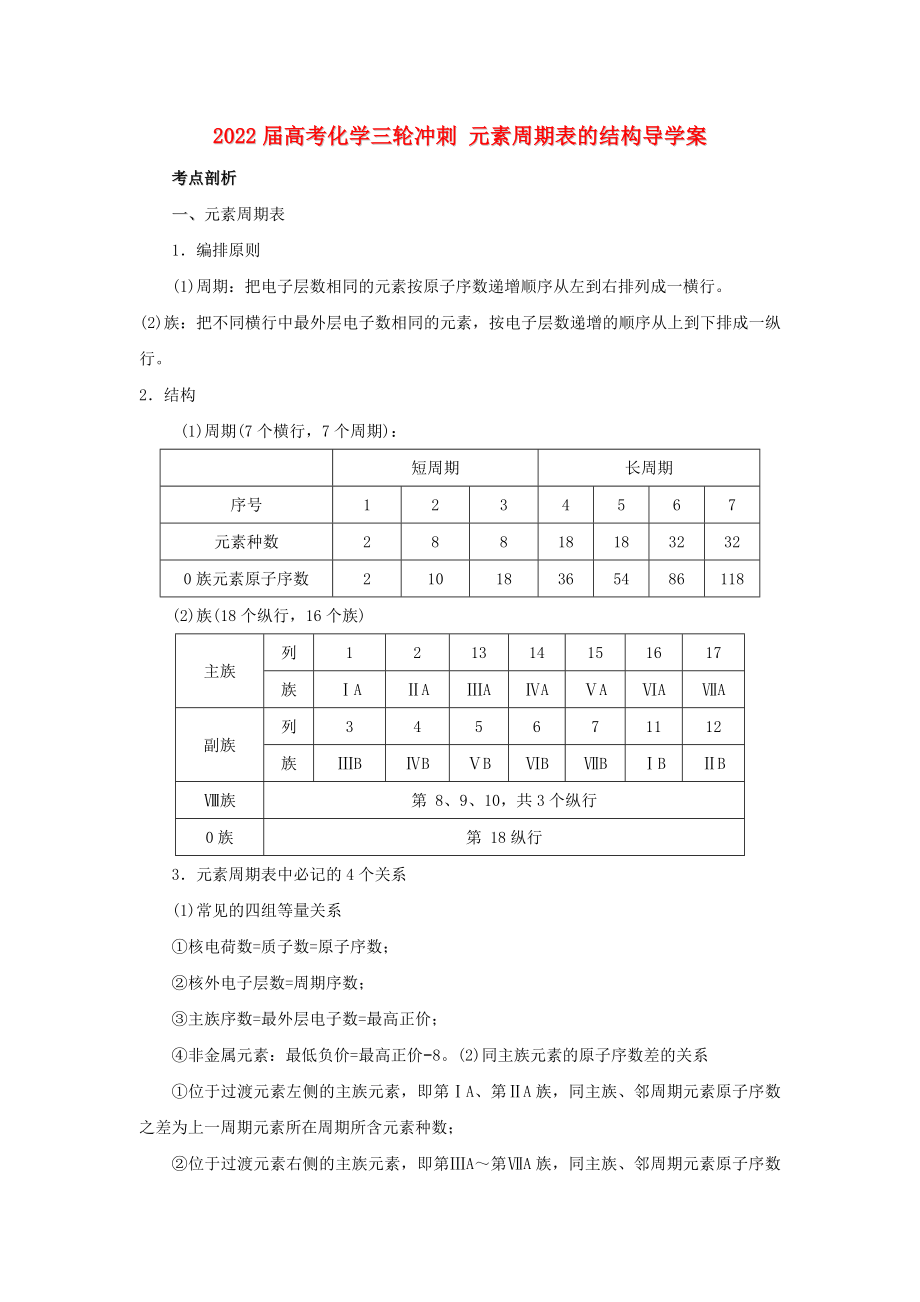
2.結(jié)構(gòu)
(1)周期(7個橫行����,7個周期):
短周期
長周期
序號
1
2
3
4
5
6
7
元素種數(shù)
2
8
8
18
18
32
32
0族元素原子序數(shù)
2
10
18
36
54
86
118
(2)族(18個縱行,16個族)
主族
列
1
2
13
2��、14
15
16
17
族
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
副族
列
3
4
5
6
7
11
12
族
ⅢB
ⅣB
ⅤB
ⅥB
ⅦB
ⅠB
ⅡB
Ⅷ族
第 8��、9���、10,共3個縱行
0族
第 18縱行
3.元素周期表中必記的4個關(guān)系
(1)常見的四組等量關(guān)系
①核電荷數(shù)=質(zhì)子數(shù)=原子序數(shù)��;
②核外電子層數(shù)=周期序數(shù)���;
③主族序數(shù)=最外層電子數(shù)=最高正價����;
④非金屬元素:最低負(fù)價=最高正價?8。(2)同主族元素的原子序數(shù)差的關(guān)系
①位于過渡元素左側(cè)的主族元素���,即第ⅠA�����、第ⅡA族��,同主族����、鄰周期元素原子序
3��、數(shù)之差為上一周期元素所在周期所含元素種數(shù)�����;
②位于過渡元素右側(cè)的主族元素�,即第ⅢA~第ⅦA族,同主族����、鄰周期元素原子序數(shù)之差為下一周期元素所在周期所含元素種數(shù)。例如,氯和溴的原子序數(shù)之差為35?17=18(溴所在第四周期所含元素的種數(shù))���。
(3)同周期第ⅡA族和第ⅢA族元素原子序數(shù)差的關(guān)系
周期序數(shù)
1
2
3
4
5
6
7
原子序數(shù)差
無
1
1
11
11
25
25
原因
——
增加了過渡元素
增加了過渡元素和鑭系或錒系元素
(4)奇偶關(guān)系
①原子序數(shù)是奇數(shù)的主族元素�����,其所在主族序數(shù)必為奇數(shù)�����;
②原子序數(shù)是偶數(shù)的主族元素���,其所在主族序數(shù)
4、必為偶數(shù)���。4.利用稀有氣體元素確定主族元素位置
第一~第七周期稀有氣體元素的原子序數(shù)依次為:2����、10���、18、36��、54���、86����、118。
確定主族元素在周期表中位置的方法:原子序數(shù)?最鄰近的稀有氣體元素的原子序數(shù)=ΔZ�。
例如:①35號元素(相鄰近的是36Kr),則35?36=?1��,故周期數(shù)為四���,族序數(shù)為8?|?1|=7����,即第四周期第ⅦA族�����,即溴元素�����;②87號元素(相鄰近的是 86Rn)�����,則87?86=1,故周期數(shù)為7�����,族序數(shù)為1���,即第七周期第ⅠA族���,即鈁元素。
典例精析
下列關(guān)于元素周期表的說法�����,正確的是
A.元素周期表的第8�����、9�����、10三縱列合稱Ⅷ族����,Ⅷ族是元素周期表所有族中元
5、素種類最多的族
B.元素周期表中的所有副族元素都是金屬元素�����,副族包含過渡元素和Ⅷ族
C.金�����、銀����、銅、鐵���、鈉五種金屬元素中�����,只有鈉屬于主族元素
D.O��、S���、Na�、K原子半徑依次增大����;KOH、Ca(OH)2���、Mg(OH)2�、Al(OH)3的堿性逐漸增強(qiáng)
【答案】C
【解析】A項��,ⅢB是元素周期表中元素種類最多的族�,故A錯;B項�����,過渡元素包括所有的副族元素和Ⅷ族元素�����,故B錯�����;D項����,堿性:KOH>Ca(OH)2>Mg(OH)2>Al(OH)3,故D錯�����。
對點訓(xùn)練
1.若甲���、乙分別是同一周期的ⅡA族和ⅢA族元素�,原子序數(shù)分別為m和n�,則下列關(guān)于m和n的關(guān)系一定不正確的是
A.n=m+1
6、 B.n=m+18
C.n=m+25 D.n=m+11
【答案】B
【解析】對于第二���、三周期����,同一周期的ⅡA族和ⅢA族元素的原子序數(shù)只相差1�,而對于第四、五周期來說�����,由于存在過渡元素�,同一周期的ⅡA族和ⅢA族元素的原子序數(shù)則相差11����;而對于第六��、七周期來說����,由于存在鑭系和錒系元素,同一周期的ⅡA族和ⅢA族元素的原子序數(shù)則相差25����。
2.已知X、Y�����、Z三種主族元素在元素周期表中的位置如圖所示���,設(shè)X的原子序數(shù)為a�����。則下列說法不正確的是
A.Y與Z的原子序數(shù)之和可能為2a
B.Y的原子序數(shù)可能為a?17
C.Z的原子序數(shù)可能為a+31
D.X����、Y、Z一定為短
7�����、周期元素
【答案】D
【解析】由題給信息可知�����,X���、Y、Z只能位于元素周期表中過渡元素區(qū)域的右邊�,則:若X、Y�����、Z同為短周期元素�,由X的原子序數(shù)為a可知,Y的原子序數(shù)為a?8+1=a?7����,Z的原子序數(shù)為a+8?1=a+7,A正確����;若X為長周期非金屬元素��,Y為短周期非金屬元素�,則Y的原子序數(shù)可能為a?18+1=a?17���,B正確�����;若Z為第六或第七周期元素�,因存在鑭系或錒系元素��,則Z的原子序數(shù)可能為a+32?1=a+31�,C正確。
3.根據(jù)元素周期表判斷���,下列敘述不正確的是
A.兩短周期元素原子序數(shù)相差8�,則周期數(shù)一定相差1
B.L層電子為奇數(shù)的所有元素所在族的序數(shù)與該元素原子的L層電子數(shù)相
8����、等
C.所有主族元素的最高化合價與它的族序數(shù)數(shù)值相等
D.某元素原子的核電荷數(shù)為53,則該元素位于第五周期、ⅦA族
【答案】C
【解析】在短周期里���,除第一周期含兩種元素外����,其余兩個周期所含元素都是8種�。若兩元素原子序數(shù)相差8,則不可能在同一周期也不可能相差兩個周期�����,A正確��;L層電子為奇數(shù)����,則一定是核外最外層電子����,其所在族的序數(shù)與該元素原子的L層電子數(shù)相等,B正確����;氟元素沒有正價,C錯誤;稀有氣體元素Xe是54號元素�����,故核電荷數(shù)為53的元素位于第五周期ⅦA族����,D正確。
4.近年來連續(xù)出現(xiàn)的鉈中毒事件��,給各科研單位及學(xué)校危險藥品的管理敲響了警鐘�����。鉈的相關(guān)信息卡片如圖所示:
(1)鉈
9����、的原子序數(shù)為81,鉈在元素周期表中位于第______周期第______族����。
(2)若設(shè)鉈的質(zhì)量數(shù)為A,則鉈原子中中子數(shù)和質(zhì)子數(shù)之差為________�����。
(3)下列推斷正確的是________。
A.單質(zhì)的還原性:Tl>Al
B.原子半徑:Al> Tl
C.堿性:Al(OH)3>Tl(OH)3
D.氧化性:Tl3+>Al3+
(4)鉈(Tl)是某超導(dǎo)材料的組成元素之一����。Tl3+與Ag在酸性介質(zhì)中發(fā)生反應(yīng):Tl3++2Ag===Tl++2Ag+。下列推斷正確的是________���。
A.Tl+最外層有1個電子
B.Tl能形成+3價和+1價的化合物
C.Tl3+的氧化性比Ag+弱
10�、
D.Tl+的還原性比Ag強(qiáng)
【答案】(1)六 ⅢA
(2)A?162
(3)A
(4)B
【解析】(1)推斷Tl在元素周期表中的位置�����,可利用各周期的元素種類數(shù)(2��、8��、8�����、18��、18���、32)進(jìn)行分析,81?2?8?8?18?18=27,首先推知該元素位于第六周期����,第六周期中鑭系有15種元素占一個格,則27?14=13�。根據(jù)元素周期表的結(jié)構(gòu)可知,第13縱行為第ⅢA族�,即Tl在元素周期表中的位置為:第六周期第ⅢA族。
(2)根據(jù)A?Z=N�,可知鉈原子中中子數(shù)和質(zhì)子數(shù)之差為(A?Z)?Z,即A?162���。
(3)根據(jù)元素周期律的遞變規(guī)律���,同主族從上至下,元素金屬性逐漸增強(qiáng)��,單質(zhì)還原性增
11����、強(qiáng),原子半徑增大����,離子氧化性減弱����,堿性增強(qiáng)����。
(4)鉈位于第ⅢA族,說明鉈原子最外層有3個電子�,則Tl+最外層有2個電子,A錯誤��;由Tl3++2Ag===Tl++2Ag+知��,Tl3+的氧化性比Ag+強(qiáng)�����,Ag的還原性比Tl+強(qiáng)����,C���、D錯誤���。
5.如表所示是元素周期表的一部分�。表中所列的字母分別代表某一化學(xué)元素����。
請你根據(jù)表中所給元素,回答下列問題:
(1)在所給短周期元素中____的原子半徑與_____的原子半徑之比最小 (填元素符號)���。
(2)表中金屬性最強(qiáng)的元素與氧氣反應(yīng)生成化合物的化學(xué)式是________(填兩種即可)�����,i和j氫化物比較����,穩(wěn)定性強(qiáng)的是________(填寫氫化
12����、物化學(xué)式)。
(3)海水中除氫��、氧元素外含量最多的元素����,其單質(zhì)或化合物也是自來水生產(chǎn)過程中常用的消毒殺菌劑,其單質(zhì)能做消毒殺菌劑的原因是____________________________________(用化學(xué)方程式表示)����。
(4)寫出均由a����、b���、h�、j四種元素所形成的兩種化合物的水溶液相互反應(yīng)的離子方程式:_____________���。
(5)常溫下某液態(tài)化合物只含上述元素的兩種���,分子中原子個數(shù)比1∶1,請你僅用一個化學(xué)方程式表示該液態(tài)化合物既有氧化性又有還原性:____________________________��。
【答案】(1)H Na (2)K2O��、K2O2���、KO2
13�、(任填兩種) HF
(3)Cl2+H2OHCl+HClO
(4)H++===SO2↑+H2O
(5)2H2O22H2O+O2↑
【解析】(1)在所給短周期元素中氫原子半徑最小��,鈉原子半徑最大��,二者比值最小�。
(2)在元素周期表前四周期元素中鉀元素的金屬性最強(qiáng),金屬鉀與氧氣反應(yīng)可生成K2O�、K2O2,甚至生成KO2��;i為F元素���,j為S元素���,F(xiàn)的非金屬性比S強(qiáng),故HF的穩(wěn)定性強(qiáng)于H2S���。
(3)海水中除氫����、氧元素外含量最多的元素是Cl����,Cl2做消毒殺菌劑的原因是Cl2+H2OHCl+HClO。
(4)a����、b�、h�����、j四種元素分別為Na�����、H��、O��、S��,四種元素所形成的兩種化合物分別為NaHSO4和NaHSO3��,二者的水溶液相互反應(yīng)的離子方程式為H++===SO2↑+H2O�����。
(5)分子中原子個數(shù)比1∶1����,且常溫下呈液態(tài)的化合物是H2O2,在H2O2的分解反應(yīng)中,H2O2既做氧化劑又做還原劑�。
 2022屆高考化學(xué)三輪沖刺 元素周期表的結(jié)構(gòu)導(dǎo)學(xué)案
2022屆高考化學(xué)三輪沖刺 元素周期表的結(jié)構(gòu)導(dǎo)學(xué)案