《2017-2018學年高中化學 第一單元 走進化學工業(yè)課件人教版選修2(共26張PPT)》由會員分享���,可在線閱讀����,更多相關《2017-2018學年高中化學 第一單元 走進化學工業(yè)課件人教版選修2(共26張PPT)(26頁珍藏版)》請在裝配圖網上搜索�。
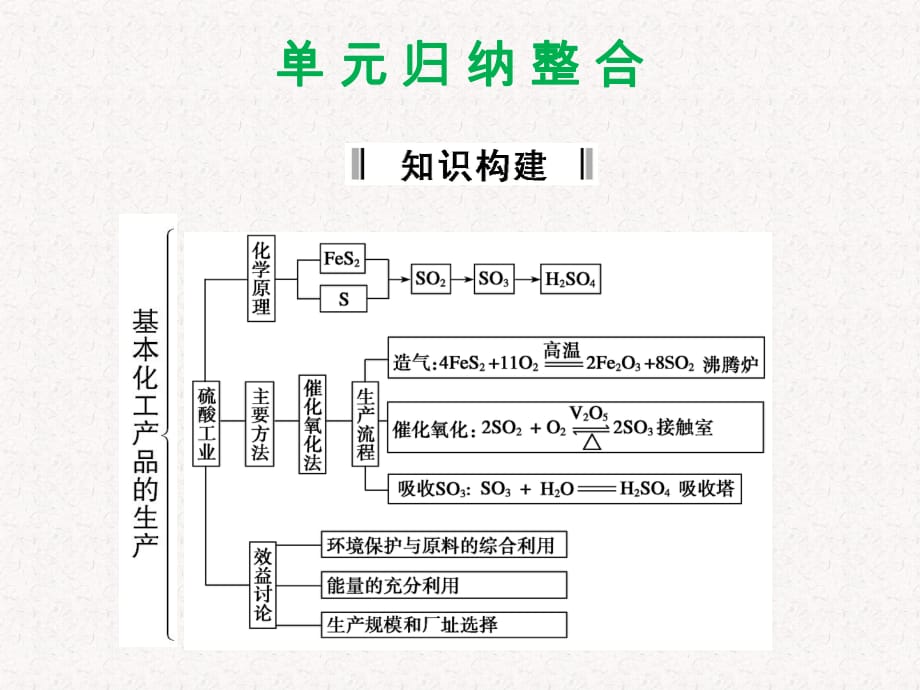
1、單 元 歸 納 整 合 專題一 | 以硫酸工業(yè)為例分析廠址選擇和綜合效益1整體思路 由于硫酸是腐蝕性液體�,不便貯存和運輸,因此要求把硫酸廠建在靠近硫酸消費中心的地區(qū)��。工廠規(guī)模的大小��,主要由硫酸用量的多少來決定�。硫酸廠選址應避開人口稠密的居民區(qū)和環(huán)境保護要求高的地區(qū)。2概括整合 磷肥���、曬鹽����、脫硫等行業(yè)生產過程中會產生大量的石膏�,不僅污染水源���,還占用了大量土地,利用它可以生產硫酸�。在高溫條件下,用碳作還原劑����,將硫酸鈣中的硫還原,再利用其還原產物制硫酸���,由于這一過程需要消耗大量的能量�����,因而一般是聯(lián)產水泥,用石膏代替石灰石��,在回轉窯中與焦炭��、輔料一起煅燒���,CaSO4被還原得到CaO和SO2��,CaO與輔
2���、料反應制得水泥熟料����,SO2隨窯氣排出����,經除塵、凈化�����、干燥�����、轉化���、吸收等過程即可制得硫酸���。(1)寫出在回轉窯中得到SO 2的化學方程式_ _,寫出CaO在回轉窯中與SiO2發(fā)生反應的化學方程式_����。 【典例1】 (2)下圖是硫酸工業(yè)中用到的設備之一�����,其名稱是_�。在生產過程中����,沒有采用加壓措施的原因是_。它有A���、B�、C��、D四個氣體的進出口���,已知經除塵���、凈化�、干燥的氣體主要成分為N2、O2�、SO2,填寫下表: 解析根據題給信息知����,在焦炭的作用下���,CaSO4被還原得到CaO和SO2,碳是還原劑�,硫的化合價降低了,硫酸鈣是氧化劑�����,由此可得到回轉窯中發(fā)生的化學反應����。結合硫酸工業(yè)的相關知識,這一過程實際上相當
3�、于硫酸工業(yè)的第一步:造氣。接下來氣體進入接觸室�����,進行接觸轉化���,再進一步被吸收��。 (2)接觸室常壓下SO2的轉化率已經很高了����,加壓會增加生產成本 (3)80% 專題二 | 純堿的生產 工業(yè)制純堿時,第一步是通過飽和食鹽水�、氨和二氧化碳反應,獲得碳酸氫鈉結晶�����,它的反應原理可以用下面的化學方程式表示:NH 3CO2H 2O=NH 4H CO3NH 4H CO3NaCl(飽和)=NaH CO3NH 4Cl以上反應的總結果是放熱反應����。請設計一個實驗,用最簡單的實驗裝置模擬實現這一過程�,獲得NaH CO3結晶?����?晒┻x擇的實驗用品有6 molL1鹽酸���、6 molL1硫酸��、濃氨水、氫氧化鈉����、石灰石��、氯化銨���、食
4、鹽����、蒸餾水、冰���,以及中學化學常用儀器�����?����!镜淅?】 (1)畫出實驗裝置示意圖(包括反應時容器中的物質)����,并在圖中玻璃容器旁自左至右分別用A、B���、C符號說明�����。(說明:本題裝置示意圖中的儀器可以用下面的方法表示�。 鐵架臺���、石棉網��、酒精燈��、玻璃導管之間的連接膠管等�����,在示意圖中不必畫出�����。如需加熱���,在加熱的儀器下方用“”表示���。)(2)請寫出圖中A、B����、C各玻璃容器中盛放物質的化學式或名稱�����。A_��;B._��;C._�����;D._�����。(3)如何利用本題所提供的實驗用品�,判斷所得到的產品是碳酸氫鈉的結晶,而不是碳酸氫銨或食鹽結晶����? 解析(2)分析反應原理�����,制NaH CO3需濃氨水���、飽和NaCl溶液和CO2,由已知反應物首先
5����、應制備CO2并凈化。制NaH CO3是利用NaH CO3溶解度不大的原理��,但整個反應過程是放熱的����,根據影響固體溶解度的因素應降溫。由于濃氨水揮發(fā)出NH 3����,所以應作尾氣處理。 答案(1)示意圖見下圖��。(2)CaCO3��,并由漏斗加入6 molL1鹽酸蒸餾水冰水(或冷水)飽和氯化鈉的濃氨水溶液30%硫酸(3)取少量產品放在試管中,在酒精燈下加熱至不再有氣體放出時����,停止加熱。試管中如有白色剩余物質���,則得到的產品不是碳酸氫銨。試管冷卻后���,向其中加入適量鹽酸�����,產生大量氣泡��,最后剩余物全部溶解�,說明得到的結晶是 碳酸氫鈉���。如果加入鹽酸后�����,晶體全部溶解�����,但沒有氣泡產生�,則得到的結晶是食鹽。 接觸法制硫酸時涉
6�����、及三個連續(xù)反應�,所以在關于工業(yè)制硫酸的計算性題目中往往涉及這幾步連續(xù)反應的計算。而對于連續(xù)多步反應的計算通常使用關系式法���,這樣就避免了對中間產物的繁瑣計算�,節(jié)約了時間���,提高了計算結果的準確性���。關系式法解題需要找準關系式,找關系式的一般方法是根據涉及的多步反應的化學方程式�,依照原子質量守恒或電子轉移數目守恒的原則找出連續(xù)多步反應中原子的轉化關系,如在用硫鐵礦制硫酸時���,根據轉化過程中硫原子守恒的原則可以找到這樣的關系式:專題三 | 硫酸工業(yè)中連續(xù)多步反應的計算 FeS22SO22SO32H 2SO4��;或SSO2SO3H 2SO4在硫酸工業(yè)制硫酸的有關計算中通常就利用以上兩關系式解題���。另外����,在有關計
7�����、算中往往還涉及物質的轉化率和損失率的問題��,這在連續(xù)多步反應的有關計算中也是一個難點問題�����。對于這一類的問題�����,需要我們掌握這樣幾個原則:(1)一種化合物中�����,一種元素的轉化率等于該化合物的轉化率��, 例如在FeS 2向SO2轉化的過程中�����,若硫元素的轉化率為99%�,則FeS2的轉化率也為99%。 (2)在同一個化學反應或多個相關聯(lián)的化學反應中�,具有個別元素質量守恒關系的反應物和生成物,反應物的轉化率等于生成物的產率����,例如在FeS2向SO2轉化的過程中,FeS2的轉化率必等于SO2的產率��,在FeS2向H 2SO4轉化的過程中���,FeS2的轉化率等于H 2SO4的產率���。 黃鐵礦主要成分是FeS2。某硫酸廠在進
8��、行黃鐵礦成分測定時��,取0.100 0 g樣品在空氣中充分灼燒,將生成的SO2氣體與足量Fe2(SO4)3溶液完全反應后�,用濃度為0.020 00 molL1的K2Cr2O7標準溶液滴定至終點,消耗K2Cr2O7標準溶液25.00 mL�。已知:SO22Fe32H 2O=SO422Fe24HCr2O726Fe214H=2Cr36Fe37H 2O(1)樣品中FeS 2的質量分數是(假設雜質不參加反應) _。(2)若灼燒6 g FeS2產生的SO2全部轉化為SO3氣體時放出9.83 kJ熱量�,產生的SO3與水全部化合生成H 2SO4,放出13.03 kJ熱量���,寫出SO3氣體轉化為H 2SO4的熱化學方程式:_��。 【典例3】 (3)煅燒10 t上述黃鐵礦��,理論上產生SO2的體積(標準狀況)為_L�,制得98%的硫酸質量為_t����,SO2全部轉化為H 2SO4時放出的熱量是_kJ�。
 2017-2018學年高中化學 第一單元 走進化學工業(yè)課件人教版選修2(共26張PPT)
2017-2018學年高中化學 第一單元 走進化學工業(yè)課件人教版選修2(共26張PPT)